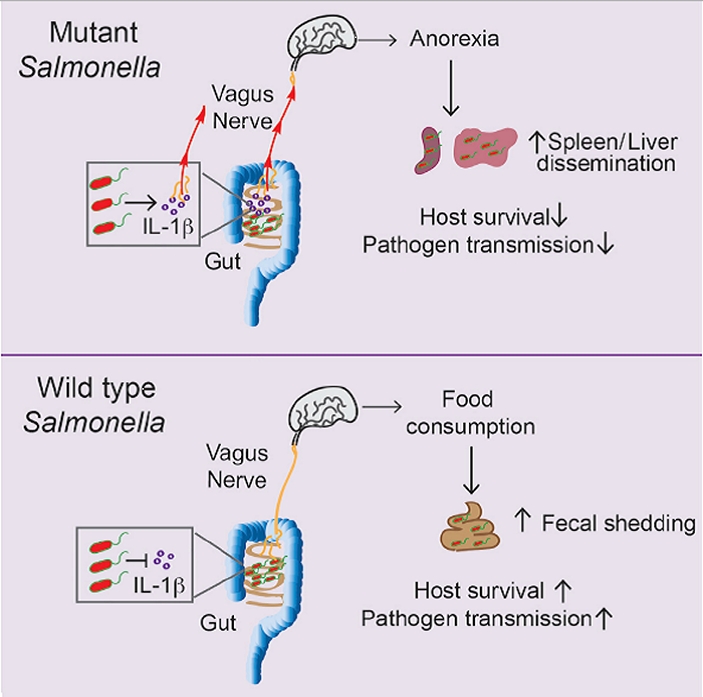
Рис. 1. Схематическое изображение основных итогов исследования. Вверху: сальмонеллы, лишенные способности производить белок SlrP (Mutant Salmonella), провоцируют передачу сигнала об инфекции из кишечника в гипоталамус. Система передачи сигнала вводит интерлейкин 1β и блуждающий нерв (nervus vagus). Это ведет к анорексии, какая, в свою очередь, способствует проникновению микробов в селезенку и печень. В итоге смертность зараженных животных растет, а эффективность распространения бактерии снижается. Внизу: нормальные сальмонеллы (Wild type Salmonella) при поддержки белка SlrP блокируют передачу сигнала в гипоталамус, и потому зараженная мышь продолжает нормально питаться. В результате бактерии не проникают в печень и селезенку, а мышь изготовляет больше помета, посредством которого происходит заражение иных мышей. Рисунок из обсуждаемой статьи в Cell
Снижение аппетита при инфекционных заболеваниях — типическая защитная реакция организма, которая, однако, не всегда идет ему на прок. Американские биологи обнаружили, что патогенная бактерия Salmonella enterica serovar Typhimurium изготавливает специальный белок, блокирующий работу сигнальной системы, какая отвечает за снижение аппетита при кишечных инфекциях у мышей. В итоге зараженные мыши продолжают активно питаться, что облегчает течение заболевания и снижает смертность, а также помогает бактерии заражать новоиспеченных жертв.
Многие паразиты повышают свой репродуктивный успех, манипулируя поведением хозяев. Стратегии, применяемые паразитами-манипуляторами, могут быть весьма утончёнными (см. ссылки в конце новости). Обычно это не идет на пользу хозяину, но вероятны и исключения, поскольку во многих случаях паразит сам заинтересован в том, чтобы хозяин жил длинно и счастливо, помогая при этом паразиту заражать новых хозяев.
Увлекательный пример манипуляции, идущей на пользу одновременно и паразиту, и хозяину, заметили американские биологи в ходе изучения взаимоотношений патогенной бактерии Salmonella enterica serovar Typhimurium со своими жертвами, в роли каких выступали лабораторные мыши. Авторы обнаружили, что эффекторный белок (см. Bacterial effector protein) SlrP (Salmonella leucine rich repeat protein), выделяемый сальмонеллой, идет на прок зараженным животным, облегчая течение болезни и снижая смертность (рис. 2). Мыши, зараженные сальмонеллами без гена slrP, скорее теряли вес и чаще погибали по сравнению с такими же мышами, зараженными сальмонеллами дикого образа.

Рис. 2. Процент выживших (слева) и средняя масса тела (справа) мышей, зараженных обыкновенной сальмонеллой (синие линии) и сальмонеллой без гена slrP (алые линии). По горизонтальной оси — дни после заражения. Рисунок из обсуждаемой статьи в Cell
Инфекции нередко вызывают у млекопитающих характерный комплекс реакций, включающий повышение температуры, снижение двигательной активности и утрату аппетита (анорексию). Считается, что эти реакции имеют адаптивный нрав и помогают животному поскорее выздороветь. Впрочем, в ряде изысканий было показано, что анорексия идет на пользу организму вдали не при всякой инфекции, не у всех модельных видов и не при любых обстоятельствах.
Исследователи предположили, что воздействие SlrP на ход заболевания может быть связано с пищевым поведением зараженных мышей. Ранее уже было показано, что обыкновенные сальмонеллы, попадая в кишечник, немного портят мышам аппетит. Новоиспеченные эксперименты показали, что сальмонеллы без гена slrP (штамм ΔslrP) возбуждают намного более сильную анорексию, чем сальмонеллы дикого образа, причем разница становится заметна уже в первые сутки после заражения.
С чем это связано? Может быть, с тем, что сальмонеллы ΔslrP скорее размножаются в зараженной мыши, быстрее поражают какие-то значительные органы? Или, может быть, анорексия объясняется влиянием сальмонелл ΔslrP на иных бактерий, живущих в кишечнике? Эти предположения были тщательно проверены — и не подтвердились. В первые дни после заражения, когда анорексия уже четко сформулирована, но смертность еще нулевая, численность бактерий и в кишечнике и во всех иных органах и тканях инфицированных животных не различается при заражении обыкновенными сальмонеллами и ΔslrP. Опыты по заражению сальмонеллами безмикробных мышей (см. Germ-free animal) показали, что и у них тоже сальмонеллы дикого образа не так сильно снижают аппетит, как ΔslrP. Значит, дело не в том, что ΔslrP воздействует на кишечную микробиоту.
Следующая серия опытов показала, что анорексия вовсе не идет на прок больным мышам. Выяснилось, что если животных, зараженных обыкновенной сальмонеллой, держать на ограничительной диете, то болезнь протекает тяжче, а смертность становится такой же высокой, как и при заражении сальмонеллами ΔslrP. Если же, навыворот, в принудительном порядке кормить мышей, зараженных ΔslrP, это повышает их шансы на выживание.
Полученные итоги показывают, что бактериальный белок SlrP, по-видимому, вмешивается прямо в работу сигнальной системы, которая отвечает за отключение аппетита в ответ на кишечную инфекцию. Авторы выдвинули ряд гипотез о том, как это может трудиться, и стали проверять их одну за другой. После нескольких негативных результатов и отвергнутых гипотез они нашли то, что искали. Ранее было показано, что значительную роль в снижении аппетита при инфекциях играет интерлейкин 1β (IL-1β). Выяснилось, что попадание сальмонелл ΔslrP (но не обыкновенных сальмонелл) в кишечник мыши приводит к резкому повышению степени IL-1β в тонком кишечнике (но не в других тканях и отделах пищеварительного большака). При этом у мышей с неработающим геном il-1β заражение сальмонеллой ΔslrP не углубляет анорексию и не повышает смертность по сравнению с заражением обычной сальмонеллой.
Таким манером, ситуация в общих чертах прояснилась. Стало ясно, что белок SlrP, выделяемый сальмонеллами, подавляет производство IL-1β в ювелирном кишечнике. Это предохраняет мышей от потери аппетита. Мыши вяще едят, что, в свою очередь, повышает их сопротивляемость инфекции.
Исследователи не стали на достигнутом и провели дополнительные эксперименты, чтобы выяснить детали. Они установили, что сальмонеллы сначала проникают в клетки эпителия ювелирного кишечника, а затем в лимфоидную ткань (см. Lamina propria) и находящиеся там лейкоциты. Тут выделяемый бактериями белок SlrP блокирует активацию инфламмасом, какие поэтому не могут перевести в активное состояние фермент каспазу-1, какой, в свою очередь, не может из-за этого синтезировать интерлейкин IL-1β из белка-предшественника (pro-IL-1 β).
Удалось также показать, что анорексия связана с изменением экспрессии нескольких генов (в том числе Npy, Il1b, Egr1, Plin4 и cFos) в гипоталамусе мышей в ответ на повышение степени IL-1β в тонком кишечнике. Сигнал о том, что в кишечнике стало много IL-1β, поступает в мозг по блуждающему нерву. Если перерезать ветви блуждающего нерва, тянущиеся от ювелирного кишечника, то мыши перестают реагировать снижением аппетита на повышение степени IL-1β (о влиянии кишечных бактерий на гипоталамус при посредничестве блуждающего нерва см. также: Кишечная микроб влияет на социальное поведение мышей, «Элементы», 21.06.2016).
Кроме того, удалось выяснить, отчего анорексия повышает смертность зараженных животных. У голодающих мышей сальмонеллы из кишечника деятельно проникают в другие органы, включая печень, селезенку и мезентериальные лимфатические узлы, и начинают там скоро размножаться. Это справделиво как для мышей, зараженных сальмонеллой ΔslrP и потому утративших аппетит, так и для мышей, зараженных нормальной сальмонеллой, но содержащихся на скудной диете. При нормальном столе сальмонеллы в основном остаются в кишечнике, а болезнь протекает легче — в том числе и у мышей, зараженных ΔslrP, если кормить их насильно.
Итак, сальмонеллы изготавливают эффекторный белок, который не позволяет зараженной мыши отреагировать на инфекцию острой потерей аппетита, и это хорошо для мышей. Бактерия как будто поправляет ошибку в защитной программе мыши, которая в данном случае трудится неоптимально: отключать аппетит при заражении сальмонеллой вредно, но мышь все равновелико пытается его отключить. Спасибо бактерии, которая не позволяет ей этого сделать.
Осталось постигнуть главное: зачем это нужно самой бактерии. Авторы предположили, что микроб таким способом повышает эффективность своего распространения. Эксперименты подтвердили эту гипотезу. Очутилось, что в помете мышей, зараженных обычной сальмонеллой, бактерий существенно вяще, чем у мышей, зараженных сальмонеллой ΔslrP. Вероятно, это объясняется тем, что у неплохо питающихся мышей сальмонеллы живут в основном в кишечнике, а у голодающих — разбегаются по иным органам. Самого помета в первом случае тоже получается вяще, поскольку мыши, зараженные обычной сальмонеллой, во-первых, вяще едят, во-вторых, дольше живут. В результате обычная сальмонелла заражает иных мышей намного эффективнее, чем ΔslrP. Эксперименты по содержанию в одном помещении двух мышей, зараженной и крепкой, дали весьма убедительные результаты. Из здоровых мышей, вселённых вместе с мышью, зараженной обычной сальмонеллой, в течение месяца померло 60%. Из таких же мышей, живших с сородичем, зараженным сальмонеллой ΔslrP, за то же срок померло лишь 10% — и это несмотря на то, что при заражении сальмонеллой ΔslrP смертность рослее.
Таким образом, бактерия, помогая своей жертве, на самом деле помогает себе. Не подавая мыши быстро погибнуть и заставляя ее хорошо питаться, микроб превращает мышь в более эффективное устройство для распространения заразы.
Изыскание впервые показало, что информация о воспалительном процессе в кишечнике, поступая в мозг по блуждающему нерву, может воздействовать на экспрессию генов в гипоталамусе и стимулировать анорексию. Все это предполагалось и ранее, но не имело прямых экспериментальных подтверждений. Работа также показала, что бактерии могут мешаться в этот процесс, способствуя сохранению хорошего аппетита, то кушать фактически манипулировать пищевым поведением хозяина. Кроме того, изыскание в очередной раз проиллюстрировало идею о том, что паразиту часто бывает бездоходно быстро убивать свою жертву, и что паразит будет усердствовать настроить свою вредоносность (вирулентность) таким образом, чтобы максимизировать шансы на заражение новоиспеченных хозяев.
Полученные результаты позволяют предположить, что анорексия в ответ на кишечную инфекцию — это адаптация на благо группы, а не индивида. Отдельной мыши, заразившейся сальмонеллой, голодовать вредно. Зато ее ближайшему мышиному окружению такое поведение захворавшей в высшей степени выгодно, ведь оно резко повышает их шансы не заразиться. Такая альтруистическая адаптация могла развиться под поступком родственного или группового отбора. С другой стороны, анорексия — это типическая реакция организма на многие инфекции. Возможно, в большинстве случаев она здорова индивиду, и лишь иногда, как в случае с сальмонеллой, система не срабатывает, и голодание идет не на прок, а во вред. Расшифрованный авторами путь передачи сигнала, судя по всему, не предусматривает попадания в мозг информации о том, по какому предлогу в кишечнике повысился уровень интерлейкина IL-1β. Поэтому мозг вряд ли может оценить, какая собственно зараза завелась в кишечнике, и выдает стандартную реакцию, усаживая организм на диету.








