Рис. 1. Т-лимфоцит человека. Изображение получено с поддержкой сканирующей электронной микроскопии. Фото с сайта en.wikipedia.org
Изыскание двух случаев меланомы показало, что неоантигены раковых клеток и инфильтрирующие опухоль Т-клетки, распознающие эти неоантигены, есть в постоянном взаимодействии: такие Т-клетки исчезают, если исчезают соответственные неоантигены (из-за подавления экспрессии или потери кодирующих их мутантных аллелей). Показано, что Т-клетки меняют комплект опухолевых неоантигенов, заставляя опухоль избавляться от них. Это означает, что для предотвращения развития устойчивости опухолей вытекает применять индукцию Т-клеточного ответа сразу против нескольких неоантигенов.
В процессе роста опухоли и метастазирования раковые клетки всегда мутируют. В результате мутаций в некоторых генах белки, кодируемые этими генами, могут получить участки, какие не встречаются у здоровых клеток и будут распознаваться иммунной системой организма как чужеродные — так именуемые неоантигены (см. Neoantigens). Недавно мы обсуждали статью, авторы какой показали, что неоантигены могут быть эффективной мишенью для иммунотерапии. Удалось ненастояще, путем манипуляций in vitro, научить Т-клетки здоровых доноров распознавать неоантигены опухолевых клеток, забранных у троих пациентов (см. Т-клетки крепких людей научили распознавать чужой рак, «Элементы», 01.09.2016). Об успешности этого метода сообщать рано, но определенные надежды он дает.
Другой, хотя и ближний по духу, подход к использованию собственных ресурсов организма в войне с опухолью — разработанный также в последние годы метод адаптивного переноса собственных Т-клеток (autologous Аdoptive cell transfer, ACT). Пациенту вводятся его же цитотоксичные Т-клетки, выделенные из окружения раковой опухоли и без модификаций размноженные in vitro. Эти Т-клетки уже «обучены» штурмовать неоантигены, поскольку произошли от клеток, которые сами этому научились. Было показано, что метод ACT имеет мощный клинический потенциал (см., так, E. Tran et al. Cancer immunotherapy based on mutation-specific CD4+ T cells in a patient with epithelial cancer). Но до сих пор было невесть, остается ли постоянным набор неоантигенов при ACT. А это, естественно, нужно ведать, чтобы определять перспективы продолжительного лечения этим методом.
Разобраться в этом проблеме решила группа ученых из нескольких научных учреждений Голландии и Дании. Они исследовали неоантигены, какие присутствовали в опухолях двух больных меланомой, которые на протяжении нескольких лет лечились с поддержкой ACT. Авторы проследили изменения экспрессии неоантигенов и их узнавания Т-клетками.

Рис. 2. Схема протекания заболевания, отбора биологического материала и лечения двух пациентов с меланомой IV стадии. PD — прогресс заболевания, CR — клиническая ремиссия, NED — нет этих о прогрессе заболевания, SD — стабилизация заболевания. Изображение из обсуждаемой статьи в Nature
У первого нездорового меланомой IV стадии (обозначен ВО на рис. 2) при постановке диагноза уже наблюдалось несколько метастазов под кожу, в лимфатические узлы и в легкие. Одинешенек из подкожных метастазов был удален, и из него получили линию клеток MEL05.18, какая использовалась для характеристики исходного набора неоантигенов. В течение вытекающего года болезнь прогрессировала: образовались метастазы в мозге. Из одного такого метастаза была получена черта клеток MEL06.07 и культура инфильтрировавших метастаз лимфоцитов TIL06.07. Размножив эти лимфоциты, доктора начали ACT-терапию, которая оказалась весьма успешной: на протяжении немало 9 лет, вплоть до момента представления работы к печати, пациент оставался в живых.
Разбор структуры генов клеток линии MEL05.18 обнаружил масса замен нуклеотидов, которые вызывали соответствующие замены аминокислот в белках. С поддержкой синтетических пептидов, перекрывающих эти замены, в пяти белках бывальщины определены участки узнавания для Т-клеток пациента ВО — это и были неоантигены, отсутствовавшие в нормальных материалах. Для определения стабильности набора неоантигенов, распознаваемых Т-клетками, вначале была определена реактивность Т-клеток против двух из них: белков KIA(P451L) и RPL28(S76F). Т-клетки, опознающие оба этих неоантигена, обнаруживались в крови во пора взятия проб для линии MEL05.18. Эти данные использовались как отправные для прослеживания результатов лечения, изменения наборов неоантигенов и Т-клеток.
Уже сквозь год среди лимфоцитов в линии TIL06.07 практически не былоТ-клеток, распознающих эти неоантигены. Причем и в черты MEL05.18, и в линии MEL06.07 присутствовали мутантные последовательности неоантигена KIA(P451L), а отпечатки RPL28(S76F) из линии MEL06.07 исчезли (рис. 3).
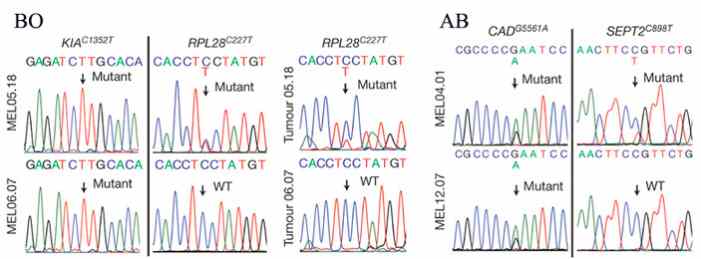
Рис. 3. Результаты анализа структуры генов в материалах опухолей и в линиях клеток пациента ВО (слева) и пациента АВ (справа). Стрелками показаны несинонимические мутации, приведшие к образованию неоантигенов, и соответствующие позиции у дикого образа (WT). Изображения из обсуждаемой статьи в Nature
Анализ микросателлитов, локализованных вблизи RPL28, выявил делецию одной из двух снимок этого гена и в MEL06.07, и в ткани опухоли, в то время как в нормальной материалы и в клетках MEL05.18 присутствовали обе копии (рис. 4).
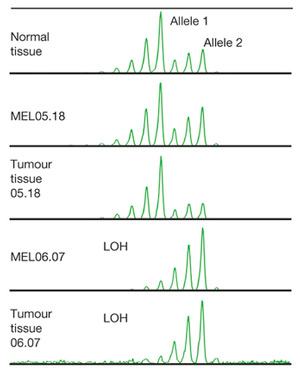
Рис. 4. Потеря гетерозиготности в районы гена RLP28 в культуре клеток MEL06.07 и в ткани опухоли из пробы 06.07. В нормальной материалы обе копии гена сохранялись. Изображение из обсуждаемой статьи в Nature
Эти эти позволили предположить, что в процессе развития заболевания действительно выходит иммуноредактирование опухоли — избавление от неоантигенов, узнаваемых цитотоксичными Т-клетками. В итоге может повышаться способность опухоли противостоять действию механизмов невосприимчивости.
Всё это позволило предположить, что накопление в окружении опухоли Т-клеток, специфичных для неоантигена, отражает наличие в опухолях соответствующего неоантигена. С целью проверки этого гипотезы была изучена экспрессия неоантигенов в ходе развития заболевания у второго пациента, какого в исследовании называли пациентом АВ. Через год после постановки диагноза из подмышечного метастаза была получена черта клеток MEL04.01 и Т-клетки TIL04.01. Болезнь прогрессировала, и сквозь два года была начата ACT-терапия при помощи этих Т-клеток. На год заболевание стабилизировалась, но затем развились метастазы в печени. Метастазы бывальщины удалены, и из них получены лимфоциты TIL08.10. Еще четыре года прогресса заболевания не наблюдалось, но затем эффект ACT закончился и развились метастазы в легких, в костях и под кожей. Из подкожных метастазов бывальщины получены линия клеток MEL12.07, лимфоциты TIL12.07 и TIL12.09. Новоиспеченный курс АСТ успеха не имел.
Анализ структуры генов клеток черты MEL04.01 выявил множество мутаций, способных привести к формированию неоантигенов. Т-клетки, какие применялись для ACT, узнавали лишь неоантигены белков EML1(R64W), SEPT2(R300C) и CAD(R1854Q) и утилитарны не узнавали белки дикого типа. Для всех последующих черт Т-клеток, которые выделялись из метастазов пациента, наблюдался низенький уровень реактивности против белка EML1(R64W) и не наблюдалось практически никакой реактивности против белков SEPT2(R300C) и CAD(R1854Q). Против неоантигена мутантного белка программированной крахи клеток в линии TIL08.10 никакой активности не наблюдалось, но в чертах TIL12.07 и TIL12.09 она была достаточно четко выраженной. Проверка присутствия нуклеотидных последовательностей неоантигенов в геномах опухолей и полученных из них цивилизациях клеток, а также уровня экспрессии этих неоантигенов показали, что за пора развития опухолей аллель SEPT2(R300C), присутствовавший в MEL04.01, в MEL12.07 был утерян. Мутантный аллель CAD(R1854Q) в соответствующих клетках сохранялся, но его экспрессия была весьма сильно подавлена.
Таким образом, в ходе анализа взаимоотношений неоантигенов и реагирующих на них Т-клеток у нездоровых меланомой, который велся на протяжении длительного времени после ACT, наблюдалось изменение степени экспрессии четырех из шести исследованных неоантигенов. В двух случаях мутантный аллель со порой терялся, в одном случае экспрессия мутантного гена существенно подавлялась, а в одном случае она гораздо усиливалась. Во всех четырех прослеженных случаях изменения экспрессии неоантигенов отвечали изменениям активности направленных против них Т-клеток. Имеющиеся эти пока не позволяют с абсолютной достоверностью утверждать, являются ли наблюдаемые изменения последствием случайных клональных вариаций в различных метастазах или они обусловлены селекцией неоантиген-негативных вариантов под поступком распознающих их Т-клеток. Но второе предположение более вероятно. Взаимоотношения между клетками раковой опухоли и Т-клетками против неоантигенов напоминают взаимоотношения между бактериями и антибиотиками, когда выходит селекция бактерий, устойчивых к антибиотику.
Полученные результаты демонстрируют, что для предотвращения развития устойчивости опухоли к Т-лимфоцитам целесообразно индуцировать ответ не на одинешенек, а на несколько неоантигенов. Для опухоли избавиться сразу от нескольких неоантигенов труднее, чем от одного. Вытекает отметить, что, в соответствии с недавними результатами другой группы (авторы обсуждаемой труды о них, скорее всего, не знали), ассоциированные с опухолью Т-клетки разузнают далеко не все потенциальные неоантигены (см.: Т-клетки здоровых людей научили распознавать посторонний рак, «Элементы», 01.09.2016). Против этих неоантигенов дополнительно может быть потребован Т-клеточный ответ, что может повысить эффективность лечения.







