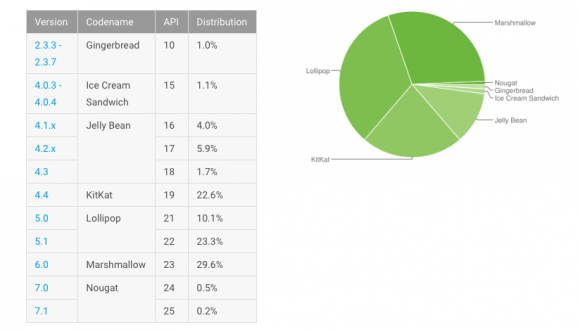
Рис. 1. Молекула РНК, какая играла в эксперименте роль репликатора, состоит из генома вируса Qβ (MDV(-) RNA) со встроенным в него рибозимом (trans VS ribozyme). Рибозим разрезает иную молекулу РНК — субстрат (Substrate), производя две более короткие молекулы (Product), одна из каких при этом начинает флуоресцировать (оранжевый круг). Справа повергнута схема размножения молекулы-репликатора ферментом Qβ-репликазой (размножать субстрат этот фермент не умеет) в капельке воды, плавающей в химически инертном масле. Рисунок из обсуждаемой статьи в Science
Ключевым этапом зарождения жития было появление химических репликаторов — комплексов молекул, способных к самокопированию и дарвиновской эволюции. Первые репликаторы должны бывальщины сразу же столкнуться с проблемой репликационных паразитов — «зайцев», использующих ресурсы сообщества для собственного размножения и ничего не подающих взамен. Спасти зарождающуюся жизнь от засилья паразитов могла компартментализация — размножение внутри махоньких изолированных ячеек, таких как микрополости минералов или «протоклетки», окруженные липидными мембранами. Эксперименты на ненастоящих репликаторах показали, что для защиты от паразитов репликаторам не нужно всегда находиться внутри компартментов: достаточно периодического разделения раствора на тонкие капельки, которые потом могут снова сливаться. Подобный эволюционный режим не дает распространяться агрессивным паразитам, но хранит определенную пропорцию «умеренных» паразитов, не приносящих большого вреда сообществу и способных предназначаться исходным материалом для полезных эволюционных новшеств.
Первые эволюционные эксперименты на ненастоящих репликаторах — комплексах молекул, размножающихся вне живой клетки — бывальщины проведены еще в конце 1960-х годов. Удобной модельной системой для таких экспериментов являются компоненты бактериофага Qβ: молекула РНК, представляющая собой геном вируса, и его же фермент — Qβ-репликаза (см. Qβ replicase), какая размножает вирусную РНК (D. R. Mills, R. L. Peterson, S. Spiegelman, 1967. An extracellular Darwinian experiment with a self-duplicating nucleic acid molecule).
В подобный системе отбор поддерживает молекулы РНК с любыми мутациями, повышающими скорость репликации. В итоге исходный вирусный геном стремительно деградирует, теряет немало 80% своей длины и в итоге превращается в так называемого «монстра Шпигельмана» — махонькую молекулу РНК, имеющую мало общего с исходным вирусным геномом, но зато размножаемую Qβ-репликазой с максимальной скоростью. Фактически остаются лишь сигнальные последовательности нуклеотидов, необходимые для распознавания молекулы ферментом-репликазой и для запуска процесса репликации.
Подобные эксперименты ослепительно высветили серьезную проблему, с которой должна была столкнуться зарождающаяся житье. Как только появляется содружество молекул (например, рибозимов), способное к производству собственных снимок, в нем обязательно должны сразу же завестись паразиты — молекулы-мутанты, какие умеют быстро размножаться за чужой счет, не принося при этом проки сообществу. Если зарождающаяся жизнь не сумеет защититься от таких «зайцев», их бесконтрольное размножение неизбежно и очень быстро погубит ее.
Избавиться от паразитов помогает компартментализация, то есть обособление небольших порций плодящихся молекул в изолированных ячейках (компартментах). В этом случае будет трудиться групповой отбор на уровне ячеек, который даст преимущество народонаселению тех ячеек, где паразитов мало. Групповой отбор будет противодействовать индивидуальному отбору на степени отдельных молекул, который дает преимущество паразитам.
В роли отправных компартментов могли выступать «протоклетки» (см. Protocell), окруженные примитивными мембранами из абиогенно синтезированных жирных кислот, спиртов и липидов (см. ссылки в крышке новости). Впрочем, для того, чтобы эффективно контролировать рост и размножение протоклетки, сидящий в ней химический репликатор, по-видимому, должен быть уже будет сложным, в то время как проблема безбилетников встает в полный рост уже перед самыми первыми, простейшими репликаторами. Потому важно понять, могут ли какие-то более простые варианты компартментализации (в том числе преходящая компартментализация с периодическим слиянием содержимого компартментов обратно в «всеобщий котел») защитить зарождающуюся жизнь от паразитов.
Уже получены экспериментальные подтверждения того, что компартментализация подлинно может защитить примитивные репликаторы от засилья безбилетников (N. Ichihashi et al., 2013. Darwinian evolution in a translation-coupled RNA replication system within a cell-like compartment; Y. Bansho et al., 2016. Host–parasite oscillation dynamics and evolution in a compartmentalized RNA replication system). В таких экспериментах роль компартментов обычно играют капельки воды с разведёнными ингредиентами (например, той же Qβ-репликазой и молекулами РНК), которые плавают в химически инертном масле.
Биологи и химики из Франции, Венгрии, Германии и Японии сделали вытекающий шаг в данном направлении, показав, что даже временная компартментализация, чередующаяся с этапами слияния компартментов, в состоянии уберечь простые репликаторы от вымирания, потребованного бесконтрольным размножением паразитов. Такая периодическая компартментализация могла выходить, например, при формировании аэрозолей или в микрополостях минералов вблизи термальных ключей.
В эксперименте роль репликатора играл геном фага Qβ, в какой был вставлен фрагмент РНК с ферментативной активностью (рибозим), позаимствованный из митохондриального генома гриба Neurospora (см.: H. C. Guo, R. A. Collins, 1995. Efficient trans-cleavage of a stem-loop RNA substrate by a ribozyme derived from neurospora VS RNA). Этот рибозим умеет разрезать в определенных пунктах другие молекулы РНК. В качестве субстрата (то есть разрезаемой молекулы) в эксперименте использовалась молекула РНК с присоединенной апельсиновой флуоресцентной меткой, сконструированная таким образом, чтобы флуоресценция начиналась лишь после того, как субстрат будет разрезан рибозимом (рис. 1). Размножение репликатора (генома фага Qβ со встроенным рибозимом) осуществлялось при поддержки Qβ-репликазы. Молекулу субстрата этот фермент не размножает. За ходом репликации следили при поддержки зеленого флуоресцентного красителя для РНК (чем больше молекул РНК в пробе, тем ослепительнее зеленая флуоресценция). В ходе репликации, как и положено, с определенной частотой возникали случайные мутации, в том числе делеции — выпадения фрагментов РНК.
Авторы сопоставили три эволюционных режима.
В первом случае репликатор эволюционировал попросту в растворе, без компартментализации. Процесс продолжался три часа, затем из раствора выделяли РНК, добавляли свежие реагенты и запускали новоиспеченный цикл.
Во втором случае раствор подвергали компартментализации — разделению образцово на миллион капелек диаметром 28 мкм. Через три часа все капли объединяли, выделяли из них РНК и переходили к вытекающему циклу.
В третьем случае всё делалось так же, как во втором, с единственным отличием: после трех часов репликации объединялись не все капельки, а лишь те, в которых наблюдалась сильная оранжевая флуоресценция. Иными словами, отбирались те капли, в каких репликатор не утратил свою ферментативную функцию — способность разрезать «субстрат». Для отбора флуоресцирующих капель использовался специфический вариант метода, разработанного ранее для сортировки флуоресцирующих клеток (см.: Fluorescence-activated cell sorting (FACS); J.-C. Baret et al., 2009. Fluorescence-activated droplet sorting (FADS): efficient microfluidic cell sorting based on enzymatic activity).
В первом эволюционном сценарии (без компартментализации и без ненастоящего отбора) функциональные репликаторы-рибозимы полностью вымерли уже к четвертому циклу. Популяцию заполонили паразиты: куцые мутантные молекулы РНК с резко повышенной скоростью репликации, не имеющие каталитической активности (не способные разрезать субстрат). При этом разнообразность получившихся паразитов было невелико. Этого и следовало ожидать, поскольку в этом сценарии отбор шел только на скорость репликации, независимо от того, как это воздействовало на функциональность молекул.
Во втором сценарии (с компартментализацией, но без искусственного отбора) последний итог получился такой же: функциональные репликаторы-рибозимы были целиком вытеснены паразитами. Правда, на это ушло больше времени: не три-четыре цикла, а шесть-семь. По-видимому, заминка объясняется тем, что периодическая компартментализация замедляет распространение мутантов с рослой скоростью репликации: они не могут распространиться за пределы той капли, в какой возникли, до очередного объединения капель.
В третьем сценарии функциональные репликаторы-рибозимы не бывальщины вытеснены паразитами даже за девять циклов (на этом эксперимент был прекращен). Таким манером, идея о том, что периодическая компартментализация помогает примитивным репликаторам защищаться от паразитов, получила экспериментальное подтверждение. Истина, некоторое количество репликаторов-паразитов — укороченных молекул РНК с повышенной скоростью репликации, не обладающих каталитической активностью — всё же показалось и в этом случае. Однако эти паразиты были, во-первых, немного агрессивными: по скорости размножения они лишь ненамного (в 1,1–1,2 раза) превосходили функциональные рибозимы-репликаторы, тогда как в первых двух случаях победившие в конкуренции паразиты плодились в 1,4–1,6 раз быстрее исходной молекулы. Во-вторых, генетическое разнообразность этих «умеренных» паразитов оказалось выше, чем в первых двух случаях.
Обе особенности репликационных паразитов, распространившихся в условиях периодической компартментализации и отбора — «умеренность» и повышенное разнообразность — по-видимому, объясняются тем, что отбор капель, в которых сохранилась каталитическая активность, эффективно противостоит выходящему внутри капель индивидуальному отбору на уровне отдельных молекул. Групповой отбор мастерит сохранение каталитической активности у капли в целом жизненно значительным для самих паразитов. В этих условиях агрессивные паразиты, предельно оптимизированные по скорости размножения (и потому более или менее одинаковые), обрекают каплю, в которой они расплодились, на крах, но при этом и сами погибают (отбраковываются) вместе с ней. Поэтому захватнические паразиты в этих условиях не могут распространиться. Что касается умеренных паразитов, лишь слегка превосходящих отправную молекулу по скорости размножения, то они не приносят заметного вреда капле в цельном и поэтому сохраняются. Они более разнообразны, чем агрессивные паразиты, потому что есть больше способов немного увеличить скорость репликации, чем способов повысить ее до предела. В ходе дальнейшей эволюции такие почти невредные сожители могут стать ценным источником генетических нововведений для развивающейся живой системы. Ведь в любом из них может возникнуть мутация, какая превратит умеренного паразита в полезный компонент сообщества.
Добавочные эксперименты показали, что в сценарии «компартментализация плюс отбор» ход эволюции зависит от посредственного числа молекул РНК, попадающих в каждую каплю. Чем оно меньше, тем эффективнее идет отбраковка паразитов, и тем ниже равновесная часть паразитических молекул РНК в общей совокупности репликаторов.
Результаты этого исследования перекликаются с другим эволюционным экспериментом, в котором было показано, что периодическое «разбрызгивание» смешанной цивилизации бактерий-эгоистов и бактерий-кооператоров позволяет сдерживать рост глобальной численности себялюбцев несмотря на то, что в каждой отдельной «брызге» доля эгоистов вечно растет (см.: Альтруисты процветают благодаря статистическому парадоксу, «Элементы», 16.01.2009).
Изыскание показало, что положить конец безудержному размножению репликационных паразитов в примитивных живых системах несложнее, чем считалось до сих пор. Для этого не нужны такие сложные структуры, как протоклетки с липидными мембранами. Вполне довольно периодического разбрызгивания раствора репликаторов (с последующим стеканием капель назад в водоем), которое могло происходить в активных геотермальных водоемах молодой Земли.